Клиника, диагностика и лечение субарахноидального кровоизлияния
Субарахноидальное кровоизлияние (САК)-разрыв кровеносных сосудов с поступлением крови в ликворные пространства под паутинной оболочкой головного мозга.
Эпидемиология
По данным ретроспективных исследований, пациенты с субарахноидальным кровоизлиянием составляют до 1% от общего количества поступивших в стационар по экстренным показаниям с жалобами на головную боль.
Частота развития САК в различных странах Мира составляет от 9 до 20 случаев в год на 100 000 населения. Наиболее часто случаи САК фиксируются в Финляндии (15-17 случаев в год на 100 000 населения) и в Японии (22,7 случаев в год на 100 000 населения).
Среди спонтанных (не связанных с травмой головного мозга) САК, наиболее частой причиной является разрыв аневризмы сосудов головного мозга (до 85%). Следующей по значимости причиной САК является перимезенцефалическое субарахноидальное кровоизлияние (10%, 21-80% от общего количества неаневризматических кровоизлияний) (см.ниже) [18].
Доля лиц с аневризмами сосудов головного мозга на основании данных аутопсии оценивается в 1-6%, при проведении ангиографии аневризмы выявляются у 0,5-1% пациентов.
Аневризмы внутримозговых артерий являются единичными в 70% - 75% случаев.
Мешотчатые аневризмы обычно формируются на сосудах Виллизиева круга, принадлежащих к каротидному бассейну.
Частота встречаемости аневризм выглядит следующим образом передняя соединительная артерия (30%), задняя соединительная артерия (25%), средняя мозговая артерия (20%), бифуркация внутренней сонной артерии (7.5%), и дистальная часть базилярной артерии (7%).[4]
Реже выявляются аневризмы глазной артерии, передней артерии сосудистого сплетения, передней мозговой артерии, околомозолистой артерии, верхней мозжечковой артерии, передней нижней мозжечковой артерии, задней нижней мозжечковой артерии, задней мозговой артерии и кавернозной части внутренней сонной артерии.
Частота разрывов выявленных случайно аневризм зависит от их размеров и расположения. Чем больше аневризма, тем выше риск её разрыва. В вертебро-базилярном бассейне аневризмы разрываются чаще, чем в каротидном.
Частота разрыва аневризм небольшого (до 7 мм) размера, расположенных в каротидном бассейне, без указаний на субарахноидальное кровоизлияние в анамнезе, крайне невелика, составляет менее 0,1% в год.
У пациентов с аневризмами большего размера со сходными характеристиками (7 - 12 мм), частота разрыва составляет 2,5% в год.
У пациентов с крупными аневризмами (>13 мм) или в случае развития аневризматического расширения задней соединительной артерии, частота разрыва составляет от 3 до 20 в год, а у гигантских аневризм — даже выше [25].
В целом, в течение жизни разрыв аневризмы происходит у 20-50% пациентов [4].
Субарахноидальные кровоизлияния составляют от 2 до 7% от общего числа инсультов.
Профиль факторов риска субарахноидального кровоизлияния сходен с таковым у других типов ОНМК - основное значение имеют артериальная гипертензия, курение и злоупотребление алкоголем.
Установлена наследственная предрасположенность к развитию аневризм. При наличии двух и более родственников первой степени с субарахноидальным кровоизлиянием, рекомендуется проведение скрининга всем остальным родственникам (класс III, уровень доказательности С). В других случаях - скрининговые исследования асимптомных пациентов нецелесообразны.
Субарахноидальное кровоизлияние вследствие разрыва аневризмы артерий головного мозга в 40% случаев заканчивается летальными исходом в ближайшее время после развития, из них 10% пациентов не успевают доставить в стационар, в течение первых суток погибает до 25% [9].
В течение первого года после развития САК погибает 50-60% пациентов.
С САК связана непропроционально большая потеря продолжительности жизни в связи с другими видами инсульта в возрастной группе < 65 лет [11]. Данные о функциональной значимости САК противоречивы: доля пациентов, у которых стойко сохраняется зависимость (по оценкам модифицированной шкалы Рэнкина) от окружающих оценивается в 8-20% [17].
Большая распространённость когнитивных и эмоционально-волевых нарушений у пациентов, особенно в течение первого года после развития заболевания, требует их рутинной оценки и коррекции. В рекомендациях по ведению пациентов с аневризматическими субарахноидальными кровоизлияниями указывается на необходимость обследования всех выписанных из стационара пациентов, включая оценки когнитивной, эмоционально-волевой сферы, уровня социальной дезадаптации (класс IIa, уровень B)
Факторы риска
Частота развития САК увеличивается с возрастом, средний возраст пациентов - 50-60 лет [29].
Наиболее значимыми факторами риска развития аневризматического субарахноидального кровоизлияния считаются артериальная гипертензия (отношение шансов 2,9 - относительный риск 2,8, и курение (отношение шансов 3,5 - относительный риск 1,9). Это независимые факторы развития субарахноидального кровоизлияния. В отношении курения показано дозозависимое влияние на риск, опасность пассивного курения не доказана. После прекращения курения риск развития САК в течение нескольких лет возвращается к исходному [2].
Статические данные о значимости употребления алкоголя как фактора риска развития субарахноидального кровоизлияния противоречивы. В ряде исследований показано дозозависимое повышение риска разрыва аневризм, у пациентов, злоупотребляющих спиртным. В исследовании Ruigrok Y.M. (2001) было установлено, что пациенты, употребляющие более 300г спирта в неделю составляют до 20% тех, у кого развивается аневризматическое САК, употребляющие 100-299г спирта в неделю - 11%.
К немодифицируемым факторам риска относят САК у родственников первой степени, женский пол, низкий индекс массы тела, аутосомно-доминантная поликистозная болезнь почек (АДПКБ), болезнь Элерса-Данлоса (тип IV), серповидноклеточная анемия, недостаточность α1-антитрипсина, эластическая псевдоксантома (синдром Гренблада-Страндберга), врождённая геморрагическая телеангиоэктазия, нейрофиброматоз I типа, туберозный склероз, фибромускулярная дисплазия, нейрофиброматоз I типа, туберозный склероз.
Несмотря на наследственную предрасположенность у ряда лиц, и большую частоту выявляемости аневризм у родственников, пациентов перенесших аневризматическое САК, универсальной программы скрининговых исследований не выработано. Однако в отдельных исследованиях приводятся рекомендации по обследованию родственников [3].
Патогенез
Развитие аневризм
Аневризмы сосудов головного мозга появляются в ходе постепенно протекающего сложного процесса изменения стенки сосудов головного мозга. Традиционно, развитие аневризм связывали с врождённым дефектом средней оболочки артерий головного мозга в области бифуркаций, однако, в настоящее время от к этой гипотезе относятся более критически. Во-первых, формирование аневризм в течение жизни указывает на большую роль приобретённых факторов, а не врождённых. Во-вторых, преимущественное выявление мешотчатых аневризм в артериях каротидного бассейна противоречит более частому выявлению дефектов средней оболочки сосудов в сосудах вертебро-базилярного бассейна.
Выделяют разорвавшиеся внутричерепные аневризмы и неразорвавшиеся внутричерепные аневризмы: последние могут быть симптомными и асимптомными.
Симптомные неразорвавшиеся аневризмы часто вызывают сдавление черепных нервов, реже, артерио-артериальную эмболию.
Асимптомные - часто являются случайными находками, при проведении обследований по поводу симптомов, не связанных с аневризмами (длительная головная боль, головокружение и т.д.) или могут выявляться при субарахноидальном кровоизлиянии как “дополнительные аневризмы”, которые не являются источником кровотечения.
Таблица 1 Совокупный (5-ти летний) риск разрыва мешотчатых аневризм
| Размер аневризмы (мм) | В анамнезе нет САК и аневризмы сосудов каротидного бассейна | В анамнезе нет САК и аневризмы сосудов вертебро-базилярного бассейна и задней соединительной артерии | САК в анамнезе |
| <7 | 0 | 2,5 | 1,5 в каротидном бассейне, 3,5 в вертебро-базилярном бассейне (включая ЗСА) |
| 7-12 | 2,6 | 14,5 | Нет данных |
| 13-24 | 14,5 | 18,4 | Нет данных |
| >25 | 40 | 50 | Нет данных |
Данные Wiebers DO, Whisnant JP, Huston J III, et al: Unruptured intracranial aneurysms: Natural history, clinical outcome, and risks of surgical and endovascular treatment. Lancet 362:103–110, 2003.
Таблица 2 Редкие причины субарахноидального кровоизлияния
| Категория | Причины |
| Воспалительные заболевания | Васкулиты |
| Сосудистые заболевания | Перемезенцефалическое кровоизлияние, артерио-венозная мальформация сосудов головного мозга (АВМ), диссекция интракраниальных артерий, каротидно-кавернозное соустье, тромбоз венозных синусов головного мозга, эклампсия, спинальная АВМ, аневризмы артерий спинного мозга, болезнь Моя-Моя |
| Инфекционные заболевания | Микотические аневризмы, гнатостомоз (гельминтоз), васкулит при болезни Лайма |
| Опухолевые заболевания | Апоплексия гипофиза (аденома), карциноматозый менингит |
| Гематологические заболевания | Коагулопатия, тромбоцитопения, серповидноклеточная анемия |
| Злоупотребление наркотиками | Кокаин, амфетамины |
| Другие причины | Эклампсия |
Перимезенцефалические субрарахноидальные кровоизлияния - вид неаневризматических кровоизлияний с характерной картиной на компьютерной томографии головного мозга — локализация крови спереди от среднего мозга в межножковой цистерне и нормальными данными ангиографии церебральных артерий. Для пациентов с перимезенцефалическим САК характерно более доброкачественное течение заболевания, по сравнению с пациентами с аневризматическим САК и другими видами неаневризматического САК. Вероятными причинами развития перимезенцефалического кровоизлияния является разрыв перфорирующих артерий вертебро-базилярного бассейна. Причинная роль патологии перфорирующих артерий подтверждается выявлением лакунарных инфарктов у пациентов перимезенцефалическими субарахноидальными кровоизлияниями (небольшие серии наблюдений, локализация лакунарных инфарктов в разных бассейнах).
Диагностика и дифференциальный диагноз
Клинические проявления
Классическим клиническим проявлением САК является острое развитие головной боли. Часто пациенты отмечают, что это «самая сильная головная боль в жизни». Приступ достигает максимальной интенсивности в течение нескольких секунд. Однако, в отдельных случаях, выраженность головной боли может быть умеренной, при этом она может купироваться анальгетиками и даже проходить спонтанно. Головная боль может быть как диффузной и генерализованной.
Нередко, головная боль развивается на фоне физической нагрузки или натуживания. Однако, по данным наблюдения с участием 500 пациентов, в 34 % случаев САК развивалось на фоне обычной физической нагрузки и 12% во сне.
От 20 до 50% пациентов с верифицированным диагнозом субарахноидального кровоизлияния за несколько дней или недель до развития эпизода кровоизлияния развивается тяжёлая головная боль - «предвестник».
Таким образом, пациенты, обращающиеся с жалобами на головную боль требуют внимательной оценки. Наряду с субарахноидальным кровоизлиянием головная боль является симптомов других опасных для жизни состояний: острое развитие отёка головного мозга и гидроцефалии, диссекции или тромбоза неразорвавшейся аневризмы, тромбоза венозных синусов головного мозга.
На основании статистических данных были установлены клинические и анамнестические признаки требующие более детальной оценки пациента, так называемые симптомы «тревоги» или красные флажки.
При субарахноидальном кровоизлиянии головная боль в отдельных случаях сопровождается транзиторной потерей сознания или падением пациента («подкосились ноги»). Далее возможно развитие рвоты.
При объективном обследовании пациента отмечаются ригидность мышц затылка, общее беспокойство и расстройства сознания различной степени, возможно развитие очаговых неврологических нарушений.
Ниже, в таблице приводится набор неврологических нарушений с наиболее частыми локализациями аневризм, с которыми они сочетаются.
Таблица 3 Набор симптомов у пациентов с аневризматическим субарахноидальным кровоизлиянием
| Симптом | Предполагаемая локализация аневризмы |
| Ригидность мышц затылка | Любая |
| Расстройства сознания | Любая (могут быть вызваны осложнениями разрыва аневризмы: гидроцефалией, гематомой или ишемией) |
| Отёк диска зрительного нерва | Любая |
| Кровоизлияние в сетчатку или под стекловидное тело | Любая |
| Парез III пары черепных нервов | Задняя соединительная артерия |
| Парез VI пары черепных нервов | Задняя черепная ямка |
| Двусторонняя слабость нижних конечностей или нарушения аппетита | Передняя соединительная артерия |
| Нистагм и атаксия | Задняя черепная ямка |
| Афазия, гемипарез или игнорирование левой половины поля зрения | Средняя мозговая артерия |
При первичном осмотре пациентов с САК доля неверных диагнозов составляет около 25% (несколько исследований, выполненных в различное время, дают сходные результаты) [12]. Чаще это клинически стабильные пациенты. По данным наблюдения в дальнейшем у 54% пациентов с не выявленным при первичном осмотре САК состояние ухудшалось [15].
Диагностические шкалы
Исход у пациентов с аневризматическим САК зависит от набора неврологических нарушений при поступлении, возраста и количества крови по данным КТ/МРТ головного мозга.
Для оценки тяжести заболевания используются шкалы, учитывающие как клинические, так и инструментальные признаки.
Первая шкала оценки тяжести состояния пациентов, основанная на клинических признаках, была предложена Хантом и Хессом в 1968 году.
Таблица 4 Сравнение шкал для оценки степени тяжести субарахноидального кровоизлияния
|
Степень | |||
|---|---|---|---|
| критерий/вероятность неблагоприятного исхода | |||
|
I |
Асимптомный пациент, или минимальная головная боль, лёгкая ригидность мышц затылка/ летальность 30% |
оценка по ШКГ* 15/14,8% эталон |
оценка по ШКГ 15/14.8% эталон |
|
II |
Лёгкая или умеренная головная боль, ригидность мышц затылка, нет неврологического дефицита за исключением поражения черепных нервов/ летальность 40% |
оценка по ШКГ 13–14 без очаговых симптомов/29,4%, ОШ 2,3** |
оценка по ШКГ 11–14/41.3%, ОШ 3,9 |
|
III |
Заторможенность, спутанность сознания, или лёгкий неврологический дефицит/ летальность 50% |
оценка по ШКГ 13–14 с очаговыми симптомами/52.6%, ОШ 6,1 |
оценка по ШКГ 8–10/74.4%, ОШ 16 |
|
IV |
Ступор, умеренный или тяжёлый гемипарез, возможны начальные признаки децеребрационной ригидности и вегетативные нарушения/ летальность 80% |
оценка по ШКГ 7–12/58.3%, ОШ 7,7 |
оценка по ШКГ 4–7/84.7%, ОШ 30 |
|
V |
Глубокая кома, децеребрационная ригидность, агональное состояние/ летальность 90% |
оценка по ШКГ 3–5/92.7%, ОШ 69 |
оценка по ШКГ 3/93.9%, ОШ 84 |
**ОШ (отношение шансов) - отношение шансов того, что событие произойдет к шансам того, что событие не произойдет. Значения ОШ от 0 до 1 соответствуют снижению риска, более 1 — его увеличению. ОШ равное 1 означает отсутствие эффекта.
***Является наиболее препочтительной шкалой по данным European Stroke Organization Guidelines for the Management of Intracranial Aneurysms and Subarachnoid Haemorrhage, 2013 (класс III, уровень доказательности С).
Риск развития вазоспазма оценивается шкале Фишера (1980), основанной на данных нейровизуализации.
Таблица 5 Шкала Фишера
| Данные КТ | Оценка |
|---|---|
| Крови не видно. | I |
| Диффузное кровоизлияние или вертикальный слой крови в цистерне менее 1 мм. | II |
| Явный сгусток в цистерне и/или вертикальный слой крови в цистерне более 1 мм. | III |
| Внутримозговое или внутрижелудочковое кровоизлияние. | IV |
Лабораторные и инструментальные исследования
КТ головного мозга
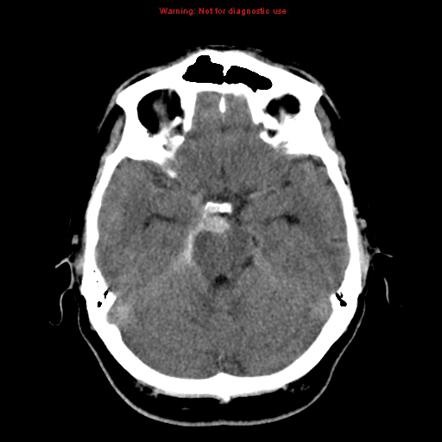
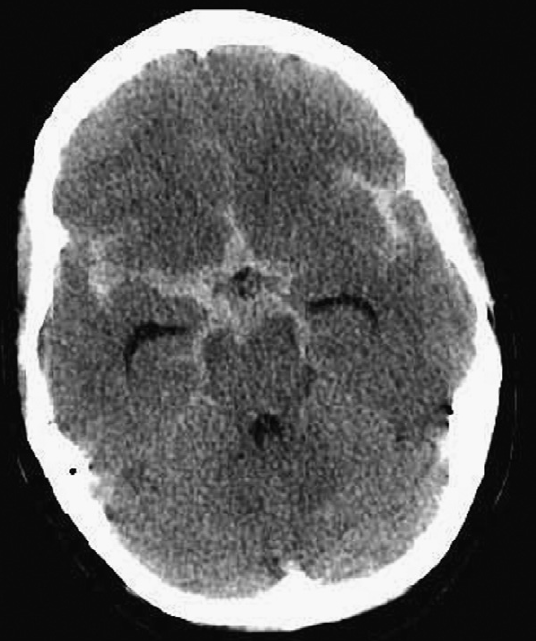
Основным диагностическим исследованием при оценке пациентов с подозрением на САК является неконтрастная КТ головного мозга. Рекомендуется проведение исследования со срезами толщиной 3 мм, поскольку при более толстых срезах (10 мм) есть возможность пропустить небольшие скопления крови.
Направление срезов должно быть параллельным твёрдому нёбу.
Поскольку повышенная плотность крови на КТ связана с содержанием гемоглобина, при снижении уровня гемоглобина менее 100г/л кровь может быть изоинтенсивной ткани головного мозга. Артефакты от движения пациента снижают диагностическую ценность исследования. Спонтанный лизис крови с течением времени уменьшает возможность постановки диагноза.
По данным Международного кооперативного исследования времени хирургического лечения аневрзимы с участием более 3500 с субарахноидальным кровоизлиянием, которым проводилось КТ головного мозга с 1980 по 1983 год, день разрыва аневризмы исследование дало положительные результаты в первый день в 92%, спустя сутки в 86%, спустя двое суток в 76%, через пять дней в 58% [13].По данным другого исследования через 5 дней после развития аневризмы КТ данные были положительными в 85% случаев, а через неделю — в 50% случаев [23].
Диагностическая ценность КТ повышается с использованием более современного оборудования и участием в оценке нейрорадиологов высокого класса. В четырёх исследованиях диагностика при помощи компьютерных томографов третьего поколения (веерный пучок излучателей, несколько вращающихся детекторов, непрерывное спиральное вращение трубки и детекторов, время сканирования 0,4-10 с) в течение первых 12 часов после развития головной боли САК выявлялось в 100% случаев (80 из 80), в течение суток в 93% случаев [22].
Люмбальная пункция
Люмбальная пункция показана пациентам с клиническими проявлениями субарахноидального кровоизлияния и отрицательными результатами КТ-сканирования или в случае невозможности проведения КТ-исследования.
Однако, эта рекомендация на практике не всегда выполняется [23].
Установлена экономическая эффективность выполнения люмбальной пункции как первого метода исследования в отдельных выборках пациентов с нормальными данными объективного исследования, метод, возможно, является безопасным, однако это не было подтверждено в клинических исследованиях [21].
Даже при удачном выполнении люмбальной пункции возможны затруднения с интерпретацией полученных результатов. Рекомендуется измерять давление спинномозговой жидкости.
В 20% случаев выявляется путевая кровь, её необходимо отличать от признаков кровоизлияния. Ни мнение врача, проводящего пункцию, ни часто используемая проба с тремя пробирками не дают достоверной информации о происхождении крови в ликворе. При получении чистого ликвора при повторной пункции выше подтверждается, что кровь, окрашивающая предыдущие порции является путевой.
Многие авторы считают надёжным маркером кровоизлияния у пациентов с негативными результатами КТ — ксантохромию (розовая или жёлтая окраска ликвора после центрифугирования, связанная с пигментами, образующимися при распаде гемоглобина) [25]. Ликвор приобретает ксантохромную окраску уже через 2 часа после попадания в него крови. Ксантохромия может сохраняться в течение двух недель, а иногда и более длительного времени [16]. Важное значение имеет скорость выполнения лабораторного анализа ликвора, поскольку, эритроциты путевой крови не подвергаются лизису in vitro. Другие считают выявление эритроцитов более надёжным признаком, чем ксантохромия [14]. Несмотря на отдельные сообщения, в которых рекомендуется выполнять люмбальную пункцию спустя 12 часов после развития головной боли, подход рассматривается как порочный поскольку увеличивает длительность обследования пациента, и сопровождается риском ухудшения состояния ввиду возобновления кровотечения.
Ангиографические исследования
Пациентам с отрицательными результатами КТ головного мозга и повторным выявлением ксантохромии ликвора или эритроцитов показана визуализация церебральных сосудов. Day и Raskin описали клинический случай, когда у пациента с выраженной головной болью и отрицательными результатами КТ головного мозга и люмбальной пункции по данным ангиографии была выявлена аневризма внутренней сонной артерии с признаками вазоспазма. После клипирования аневризмы головная боль прекратилась [6].
Raps с соавт. описали ещё семь пациентов с молниеносной головной болью и неразорвавшимися аневризмами [18].
Противоположные данные были получены в исследовании с участием 71 пациента с молниеносной головной болью. При отрицательных результатах КТ головного мозга и люмбальной пункции ни у одного из пациентов при наблюдении в течение 3,3 лет не было выявлено субарахноидального кровоизлияния [27].Приблизительно половине пациентов в последствии был выставлен диагноз «мигрень» или «головная боль напряжения».
Таким образом, в большинстве случаев, головная боль «предвестник» указывает на субарахноидальное кровоизлияние, которое может быть выявлено при адекватном использовании диагностических инструментов. В подавляющем большинстве случаев для постановки диагноза достаточно данных КТ головного мозга и люмбальной пункции.
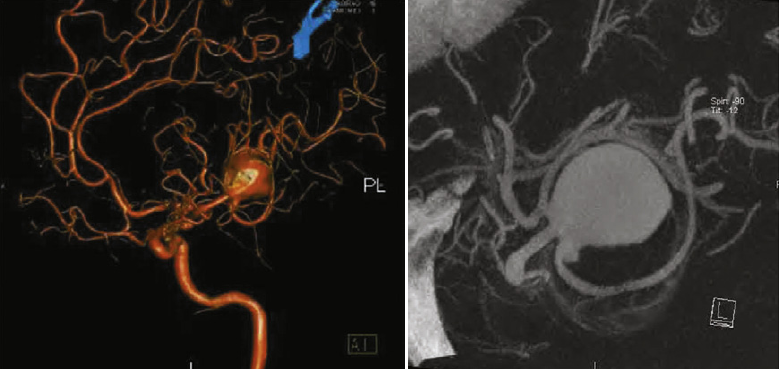
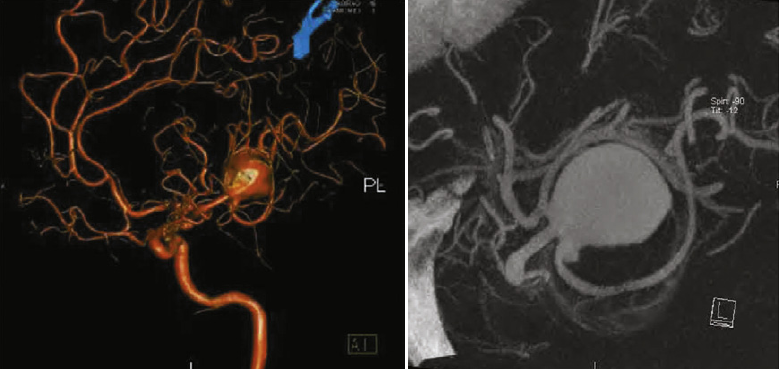
«Золотым стандартом» исследования сосудов головного мозга является церебральная ангиография (ЦА). Метод позволяет оценить все четыре брахиоцефальных артерии и их ветви. Проведение исследования при САК относительно безопасно. Частота осложнений по данным мета-анализа трёх исследований составляет 1,8% [20]. Стандартная цифровая субтракционная ангиография может быть дополнена трехмерной рентгеноконтрастной ротационной ангиографией. Это метод виртуального построения объемных моделей сосудистого русла на основе стандартных серий ангиограмм, полученных при вращении рентгеновской трубки [28].
Van Rooij с соавт. в ретроспективном обзоре возможности метода в выявлении аневризм в случае отрицательных результатов цифровой ангиографии. При трёхмерной ротационной ангиографии было выявлено 18 из 23 разорванных аневризм артерий головного мозга (78%), в 16 из 18 случаев в дальнейшем проводилось лечение либо хирургическое (n=7), либо эндоваскулярное (n=9)[24].
КТ ангиография является альтернативой проведению церебральной ангиографии, однако метод обладает меньшей точностью. Чувствительность и специфичность КТ ангиографии по сравнению с ЦА находится в диапазоне от 77% до 100%, от 87% до 100%, соответственно [5].
Представляют интерес сообщения о выявлении на КТ ангиографии аневризм, которые не были выявлены при помощи ангиографии [8].
МР-ангиография (МРА) не является адекватным методом выявления аневризм у пациентов с подозрением на аневризматическое САК. Чувствительность и специфичность по сравнению с цифровой субтракционной ангиографией находится в диапазоне от 69 до 90% [4] ,однако, эти результаты в большинстве случаев получены при оценке пациентов с неразорвавшимися аневризмами. Чувствительность для выявления мелких аневризм (<4 мм) невелика. Другими недостатками метода являются длительное время исследования, чувствительность к артерфактам движения, невозможность проведения исследования пациентам с установленными металлическими фрагментами.
Причины ошибочного диагноза САК
- Трудности с оценкой спектра клинических проявлений субарахноидального кровоизлияния
- Трудности оценки пациентов с головной болью «предвестником» (сильная, внезапная головная боль с необычными характеристиками)
- Трудности, вызванные с успешными купированием головной боли анальгетиками или самостоятельным разрешением приступа
- Переоценка значимости классических клинических проявлений, что приводит к постановке неправильного диагноза:
- Вирусная инфекция: менингит или гастроэнтерит
- Мигрень или головная боль напряжения
- Синусовая головная боль
- Боль в шее (реже, боль в спине)
- Психические заболевания
- Переоценка значимости вторичной черепно-мозговой травмы (вызванной синкопальным состоянием)
- Переоценка значимости отклонений на электрокардиограмме
- Переоценка значимости повышения артериального давления
- Недостаточность знаний о клинических симптомах аневризм до разрыва
- Трудности с пониманием ограничений компьютерной томографии
- Снижение чувствительности с течением времени от начала головной боли до проведения исследования
- Ложно-отрицательные результаты при небольшом объёме кровоизлияния
- Факторы, связанные с оценкой результатов исследования (различия в квалификации врача, оценивающего результаты визуализации)
- Технические факторы (различия в толщине среза с основания мозга, артефакты, связанные с движением)
- Ложно-отрицательные результаты при гематокрите менее 30%
- Трудности при выполнении люмбальной пункции и правильной интерпретации результатов исследования
- Трудности при выполнении люмбальной пункции у пациентов с отрицательными, противоречивыми или неубедительными результатами по данными компьютерной томографии
- Трудности с пониманием того, что ксантохромия может отсутствовать на очень ранних стадиях (<12 часов после кровоизлияния) и на очень поздних (>2 недель после кровоизлияния)
- Трудности различения «путевой» крови и истинных признаков субарахноидального кровоизлияния
Заболевания с цефалгическим синдромом, требующие специального лечения
- Субарахноидальное кровоизлияние
- Менингит
- Энцефалит
- Диссекция интимы брахиоцефальных артерий
- Височный артерии
- Острый приступ закрытоугольной глаукомы
- Гипертонический криз
- Отравление угарным газом
- Псевдоопухоль головного мозга
- Тромбоз вен и синусов головного мозга
- Инсульт (ишемический или геморрагический)
- Объёмное поражение головного мозга
- Опухоль
- Абсцесс
- Внутричерепная гематома (паренхиматозная, субдуральная или эпидуральная)
- Параменингеальные инфекционные осложнения
Лечение
Субарахноидальное кровоизлияние — неотложное состояние, требующее динамической оценки и коррекции жизненно важных функций пациента.
Ниже в таблице приводится описание подходов к лечению основных проявлений и возможных осложнений субарахноидального кровоизлияния.
Таблица 6 Лечение субарахноидального кровоизлияния
| Общие мероприятия | |
| Мониторинг гемодинамических показателей и неврологического статуса | Госпитализация в отделение интенсивной терапии, предпочтительно в специализированное неврологическое |
| Артериальное давление | Избегать гипотензии; поддерживать систолическое артериальное давление <160 мм рт.ст. до хирургического лечения аневризмы, и <200 мм рт.ст. после лечения |
| Поддержание водно-электролитного баланса | Обеспечить поступление достаточного количества жидкости при помощи физиологического раствора (до 3 л/сут) |
| Глюкоза | Дробное введение инсулина по уровню гликемии/или внутривенное введение инсулина для поддержания уровня глюкозы <7,8 ммоль/л |
| Температура | Парацетамол 325-650 мг каждые 4-6 часов, использование физических методов охлаждения для поддержания температуры <37.5°C; установить причину лихорадки |
| Нейропротекция | Нимодипин 60 мг каждые 4 часа в течение 21 дня |
| Профилактика судорожных припадков |
Фенитоин 20 мг/кг — нагрузочная доза, затем 100 мг внутривенно каждые 8 часов в течение 3-7 дней. Увеличение продолжительности приёма препарата при наличии факторов риска: судороги, внутримозговая гематома, гипертензия, инфаркт или аневризма в бассейне средней мозговой артерии. Рутинное назначение противосудорожных препаратов для длительного приёма не рекомендуется. Препараты назначаются пациентам с клиническими признаками судорожных припадков. Рутинный мониторинг ЭЭГ пациентам в нейрореанимации не рекомендуется [29]. |
| Питание | Ранее начало кормления; установка назогастрального зонда при нарушениях глотания |
| Профилактика запоров и рвоты | Своевременное симптоматическое лечение состояний, приводящих к повышению внутричерепного давления. |
| Профилактика стресс-индуцированных язв | Агонисты H2-гистаминовых рецепторов, ингибиторы протонной помпы или сукралфат |
| Профилактика тромбоэмболических осложнений |
До хирургического лечения аневризмы: использование перемежающейся компрессии и компрессионного трикотажа После закрытия анеризмы: эноксипарин 40мг подкожно х 1 раз в день, или гепарин 5000 ЕД подкожно х 3 раза в день >> |
| Лечение неврологических симптомов и осложнений | |
| Головная боль |
Парацетамол 200-500мг до 4х раз в день. Избегать назначения НПВС и салицилатов, поскольку они снижают свёртываемость крови. |
| Повторное кровотечение | Рассматривается возможность использования фибринолитических препаратов до хирургического лечения аневризмы |
| Ранее (<72 часов) хирургическое лечение аневризмы: клиппирование или эмболизация | |
| Гидроцефалия | Вентрикулостомия и наружное вентрикулярное дренирование |
| Судорожные припадки | При развитии эпилептического статуса: лоразепам 0.1 мг/кг, или нагрузочная доза фенитоина 20 мг/кг, если препарат ещё не назначен < в отечественных условиях — бензодиазепины — диазепам или мидазолам>. Немедленно выполнить ЭЭГ, определить природу припадков |
| Вазоспазм | Ежедневный скрининг — траскраниальная допплерография; по показаниям — ангиография для подтверждения выявленных нарушений. |
| Отсроченное развитие ишемии головного мозга | triple-H терапия (гипертония, гиперволемия, гемодилюция); целевое значение центрального венозного давления 8-12 мм рт.ст.; рассмотреть возможность интраартериальной ангиопластики/использования вазодилятаторов |
| Коррекция системных осложнений | |
| Нарушение работы сердца | Назначение бета-блокаторов при повышении концентрации тропонина, тахиаритмиях с узким комплексом или нейрогенной ишемии миокарда |
| Острый респираторный дисстресс-синдром | Продлённая ИВЛ с низким дыхательным объёмом (6 мл/кг идеальной массы тела) |
| Инфекция/сепсис | Удаление внутривенных и уретральных катетеров максимально быстро, после того, как отпала необходимость их использования; обработка рук; гигиена полости рта; ранняя мобилизация пациента; ранний перевод на самостоятельное дыхание |
| Электролитные нарушения | Возмещение дефицита магния, калия, фосфора и кальция |
| Гипонатриемия | Оценка волемического статуса для дифференциального диагноза между церебральным солетерающим синдромом и неадекватной секрецией антидиуретического гормона (АДГ).При развитии первого показана агрессивная заместительная терапия изотоническим или гипертоническим раствором хлорида натрия и флудрокортизон 0.1-0.2мг внутрь х 2 раза в деньПри неадекватной секреции АДГ: ограничение жидкости при адекватном контроле центрального венозного давления для поддержания эуволемии |
В ряде случаев показано хирургическое лечение: клиппирование, окклюзия спиралью или эмболизация аневризм. http://www.neurosklif.ru/Patients/Aneurysms/index.php
Использованная литература
- Active and passive smoking and the risk of subarachnoid hemorrhage: an international population-based case-control study. Stroke. 2004 Mar;35(3):633-7. Epub 2004 Jan 29
- Anderson CS, Feigin V, Bennett D, Lin RB, Hankey G, Jamrozik K; Australasian Cooperative Research on Subarachnoid Hemorrhage Study (ACROSS) Group.
- Bor AS, Koffijberg H, Wermer MJ, Rinkel GJ Optimal screening strategy for familial intracranial aneurysms: a cost-effectiveness analysis. Neurology. 2010;74(21):1671
- Brisman JL, Song JK, Newell DW: Cerebral aneurysms, N Engl J Med 355:928–939, 2006.
- Cloft HJ, Joseph GJ, Dion JE: Risk of cerebral angiography in patients with subarachnoid hemorrhage, cerebral aneurysm, and arteriovenous malformation: A meta-analysis, Stroke 30:317–320, 1999.
- Day JW, Raskin NH. Thunderclap headache: symptom of unruptured cerebral aneurysm. Lancet 1986;2:1247-8.
- Guidelines for the Management of Aneurysmal Subarachnoid Hemorrhage. A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association
- Hashimoto H, Iida J, Hironaka Y, et al: Use of spiral computerized tomography angiography in patients with subarachnoid hemorrhage in whom subtraction angiography did not reveal cerebral aneurysms, J Neurosurg 92:278–283, 2000.
- Hop JW, Rinkel GJ, Algra A, et al: Case-fatality rates and functional outcome after subarachnoid hemorrhage: A systematic review, Stroke 28:660–664, 1997.
- Hunt W., Hess R. Surgical risk as related to time of intervention in the repair of intracranial aneurysms». Journal of Neurosurgery, 1968, 28 (1): 14–20.
- Johnston SC, Selvin S, Gress DR: The burden, trends, and demographics of mortality from subarachnoid hemorrhage, Neurology 50:1413–1418, 1998.
- Jonathan A. Edlow, M.D., Louis R. Caplan, M.D. Avoiding pitfalls in the diagnosis of subarachnoid hemorrhage. The new england journal of medicine, volume 342 number 1, 2000
- Kassell NF, Torner JC, Haley EC Jr, Jane JA, Adams HP, Kongable GL. The International Cooperative Study on the Timing of Aneurysm Surgery. Overall management results. J Neurosurg 1990;73:18-36.
- MacDonald A, Mendelow AD. Xanthochromia revisited: a re-evaluation of lumbar puncture and CT scanning in the diagnosis of subarachnoid haemorrhage. J Neurol Neurosurg Psychiatry 1988;51:342-4.
- Mayer PL, Awad IA, Todor R, et al. Misdiagnosis of symptomatic cerebral aneurysm: prevalence and correlation with outcome at four institutions. Stroke 1996;27:1558-63.
- National guidelines for analysis of cerebrospinal fluid for bilirubin in suspected subarachnoid haemorrhage. UK National External Quality Assessment Scheme for Immunochemistry Working Group Ann Clin Biochem. 2003;40(Pt 5):481.
- Nieuwkamp DJ, Setz LE, Algra A, Linn FH, de Rooij NK, Rinkel GJ. Changes in case fatality of aneurysmal subarachnoid haemorrhage over time, according to age, sex, and region: a meta-analysis. Lancet Neurol. 2009;8:635– 642.
- Raps EC, Rogers JD, Galetta SL, et al. The clinical spectrum of unruptured intracranial aneurysms. Arch Neurol 1993;50:265-8.; (Avoiding pitfalls in the diagnosis of subarachnoid hemorrhage. Jonathan A. Edlow, M.D., Louis R. Caplan, M.D. The new england journal of medicine, volume 342 number 1, 2000).
- Rinne J, Hernesniemi J, Puranen M, et al: Multiple intracranial aneurysms in a defined population: Prospective angiographic and clinical study, Neurosurgery 35:803–808, 1994
- Risk of cerebral angiography in patients with subarachnoid hemorrhage, cerebral aneurysm, and arteriovenous malformation: a meta-analysis. Cloft HJ, Joseph GJ, Dion JE Stroke. 1999;30(2):317.
- Schull MJ. Lumbar puncture first: an alternative model for the investigation of lone acute sudden headache. Acad Emerg Med 1999;6:131-6.
- Sames TA, Storrow AB, Finkelstein JA, Magoon MR. Sensitivity of new-generation computed tomography in subarachnoid hemorrhage. Acad Emerg Med 1996;3:16-20.
- van der Wee N, Rinkel GJ, Hasan D, van Gijn J. Detection of subarachnoid haemorrhage on early CT: is lumbar puncture still needed after a negative scan? J Neurol Neurosurg Psychiatry 1995;58:357-9.
- van Rooij WJ, Peluso JP, Sluzewski M, et al: Additional value of 3D rotational angiography in angiographically negative aneurysmal subarachnoid hemorrhage: How negative is negative? AJNR Am J Neuroradiol 29:962–966, 2008
- Vermeulen M. Subarachnoid haemorrhage: diagnosis and treatment. J Neurol 1996;243:496-501. Xanthochromia. Lancet 1989;2:658-9
- Wermer M.J., van der Schaaf I.C., Algra A., Rinkel G.J. Risk of rupture of unruptured intracranial aneurysms in relation to patient and aneurysm characteristics: an updated meta-analysis. Stroke. 2007;38(4):1404.
- Wijdicks EFM, Kerkhoff H, van Gijn J. Long-term follow-up of 71 patients with thunderclap headache mimicking subarachnoid haemorrhage. Lancet 1988;2:68-70
- Н.Н.Малиновский, Д.В.Сальников, К.Ю.Никеров, А.С. Абрамов, Трехмерная рентгеноконтрастная ротационная ангиография в диагностике заболеваний сосудов, Журнал им. Н.И. Пирогова, 2008.
- European Stroke Organization Guidelines for the Management of Intracranial Aneurysms and Subarachnoid Haemorrhage, 2013